Tuhan
telah menciptakan alam ini lengkap dengan berbagai zat yang berfungsi untuk
menjaga kelangsungan hidup berbagai makhluk hidup. Tuhan juga telah menciptakan
berbagai proses yang dibutuhkan oleh makhluk hidup untuk menjalankan
kehidupannya. Misalnya fotosintesis yang terjadi pada tumbuhan berperan
menyediakan oksigen dan bahan makanan bagi makhluk hidup yang lain seperti
hewan dan manusia. Daun yang sudah tua kemudian jatuh menjadi sampah akan
mengalami proses pembusukan atau penguraian. Pada proses penguraian tersebut
zat-zat penyusun daun akan diubah menjadi zat-zat yang lebih sederhana dan
dapat digunakan sebagai pupuk kompos atau humus. Dari penjelasan tersebut kita
mengetahui bahwa di alam ini terjadi proses pembentukan zat-zat seperti pada
fotosintesis dan juga penguraian zat-zat seperti pada pembusukan daun. Zat-zat
yang ada di alam ini tersusun atas materi yang sangat kecil yang disebut atom.
Sumber : (Campbell:
2008), dalam web
https://drive.google.com/file/d/0B0z0-7vc3HmeTXFMUVpXU3VhNk0/view
Proses fotosintesis pada tumbuhan tersebut
memerlukan zat-zat sederhana, antara lain gas karbondioksida (CO2) dan air
(H2O). Pada proses fotosintesis tumbuhan
menyerap sinar matahari sebagai sumber energi untuk menjalankan reaksi fotosintesis yang mengubah gas karbondioksida dan air
menjadi glukosa (C6H12O6). Sedangkan klorofil
sendiri merupakan senyawa yang tersusun atas beberapa atom di antaranya karbon
(C), hidrogen (H), oksigen (O), nitrogen (N), dan magnesium (Mg).
Glukosa (C6H12O6) mempunyai atom-atom penyusun yaitu karbon (C), hidrogen
(H), dan oksigen (O). Atom-atom penyusun glukosa tersebut sama seperti
atom-atom yang terdapat dalam karbondioksida (CO2)
dan air (H2O). Bagaimana atom-atom ini dapat mengalami penyusunan
kembali untuk membentuk senyawa yang baru? Melalui reaksi kimia, zat-zat
bereaksi membentuk zat baru yang mempunyai sifat kimia yang berbeda dengan
zat-zat asalnya, contohnya yaitu pembentukan glukosa. Glukosa yang terbentuk
pada proses fotosintesis mempunyai sifat kimia dan sifat fisika yang berbeda
dengan zat-zat pembentuknya yaitu gas karbondioksida dan air. Misalnya saja,
gula berbentuk kristal dan berasa manis, sedangkan karbondioksida berupa gas
dan tidak berasa sedangkan air berwujud cair dan juga tidak berasa.
A. Molekul dalam
Benda Mati dan Makhluk Hidup
Tubuh makhluk hidup tersusun dari milyaran atom-atom, atom-atom itu berikatan
satu sama lain membentuk senyawa yang tersusun sedemikian rupa sehingga menjadi
suatu bentuk tertentu. Misalnya rambut kita yang tersusun dari molekul-molekul
yang mengandung atom karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S),
serta tulang kita antara lain mengandung unsur kalsium (Ca), fosfor (P), dan
oksigen (O).
Selain pada makhluk hidup, benda mati seperti kayu, plastik, air, udara, kain
pakaian, dan benda-benda yang lain merupakan zat kimia yang tersusun atas
molekul-molekul tertentu. Dalam senyawa, molekul-molekul tertata sedemikian
rupa sehingga memberikan sifat-sifat tertentu. Misalnya plastik bersifat lentur
karena molekul-molekul penyusunnya mempunyai rantai panjang, sedangkan arang
mudah patah karena susunan antar atom-atom penyusunnya banyak terdapat
ruang-ruang kosong. Tubuh kita dan tubuh makhluk hidup yang lainnya juga
tersusun atas berbagai molekul kimia. Molekul ukurannya sangat kecil sehingga
tidak dapat diamati dengan kasat mata dan bahkan tidak dapat diamati dengan
mikroskop biasa.
Selain disusun oleh molekul yang berbeda, sifat-sifat suatu materi yang berbeda
juga dapat disebabkan oleh perbedaan susunan molekul-molekul dalam materi itu.
Misalnya kita ambil contoh kayu yang dibuat pensil dan amilum yang ada pada
umbi kentang. Pada umbi kentang (contoh lainnya adalah umbi ketela pohon,
talas, dan beras) juga mengandung pati atau amilum yang dapat kita makan untuk
digunakan sebagai sumber energi. Pati disusun oleh molekul-molekul berantai
panjang. Rantai panjang tersebut disusun oleh unit-unit molekul yang lebih
sederhana yang disebut glukosa. Antara molekul glukosa yang satu dengan yang
lainnya dihubungkan oleh atom oksigen dengan ikatan glikosida.
Perbedaan
Struktur Senyawa: (a) Amilum pada Kentang dan (b)
Selulosa pada Pensil.
Sumber: Dokumen Kemdikbud,
dari web https://drive.google.com/file/d/0B0z0-7vc3HmeTXFMUVpXU3VhNk0/view
|
Molekul
glukosa yang menyusun amilum tersusun dari atom C, H, dan O dengan perbandingan
tertentu. Kayu yang ada pada pensil tersusun atas selulosa yang juga mempunyai
rantai panjang. Molekul panjang tersebut terdiri atas molekul-molekul glukosa
sama seperti pada pati. Selulosa dan amilum mempunyai molekul penyusun sama
yaitu glukosa tetapi jenis ikatan antarmolekul glukosanya berbeda. Selulosa
merupakan zat yang keras tetapi jika dimakan oleh manusia tidak dapat dicerna
oleh tubuh. Sedangkan amilum dapat dicerna dan digunakan sebagai bahan makanan.
Mengapa hal itu dapat terjadi? Keadaan itu menunjukkan bahwa tidak hanya jumlah
dan jenis atom-atom penyusun molekul yang menyebabkan sifat zat berbeda, tetapi
pola susunan dan jenis ikatan antarmolekul penyusun materi juga dapat
menyebabkan zat atau materi itu mempunyai sifat-sifat kimia dan sifat-sifat
fisika yang berbeda.
Masing-masing senyawa
mempunyai rumus molekul tertentu. Rumus molekul menunjukkan jenis atom yang
menyusun suatu molekul dan perbandingannya. Molekul air (H2O) yang sudah
dicontohkan sebelumnya terdiri atas satu atom O dan dua atom H. Bila dua atom O
mengikat dua atom H maka akan terbentuk senyawa yang berbeda yaitu hidrogen
peroksida (H2O2). Hal itu menunjukkan bahwa perbandingan jumlah dan jenis atom
dalam suatu molekul akan menghasilkan senyawa yang sifat dan jenisnya sangat
berbeda.
B.
Atom dan Partikel Penyusunnya
1. Partikel Subatom
1. Partikel Subatom
Walaupun
atom merupakan unit terkecil penyusun molekul, materi yang sudah sangat kecil
ini ternyata tersusun dari bagian yang lebih kecil lagi yang disebut partikel
subatom.
Amati warna lampu-lampu neon. Masing-masing lampu tersebut berisi gas mulia berturut-turut helium (He), neon (Ne), argon (Ar), kripton (Kr), dan xenon (Xe).
Amati warna lampu-lampu neon. Masing-masing lampu tersebut berisi gas mulia berturut-turut helium (He), neon (Ne), argon (Ar), kripton (Kr), dan xenon (Xe).
|
Warna Lampu yang
Berisi Gas Mulia Helium (He), Neon (Ne), Argon
(Ar), Kripton (Kr), dan Xenon (Xe)
Sumber:
www.haikudeck.com dari web https://drive.google.com/file/d/0B0z0-7vc3HmeTXFMUVpXU3VhNk0/view
|
Lampu-lampu tersebut mengeluarkan cahaya berwarna-warni
setelah dialiri arus listrik. Gas-gas yang dilewati oleh aliran listrik
tersebut berpendar sehingga menghasilkan cahaya berwarna-warni. Cahaya itu
disebabkan oleh loncatan elektron-elektron yang menyusun atom-atom gas. Elektron
adalah partikel subatom yang bermuatan negatif dan umumnya ditulis sebagai
e-.
Contoh lain adalah kembang api. Kita sering melihat cahaya
berwarna-warni dari kembang api ketika dibakar. Mengapa cahaya yang muncul
berwarna-warni? Jika pada lampu-lampu, cahaya disebabkan oleh aliran listrik,
maka pada kembang api cahaya itu dihasilkan dari terbakarnya unsur-unsur yang
ada dalam kembang api tersebut. Akibat temperatur yang tinggi,
elektron-elektron dari atom-atom penyusun unsur itu akan berpindah dari kulit
atom yang lebih tinggi ke kulit atom yang lebih rendah. Kulit atom adalah
daerah di mana dapat menemukan elektron. Kulit atom berjumlah 7. Para kimiawan
menggunakan huruf K, L, M, N, O, P, dan Q untuk menyatakan kulit atom.
Kulit K adalah kulit pertama yang paling dekat dengan inti, Kulit L : 2,
kulit M : 3, Kulit N : 4, Kulit O : 5, Kulit P : 6 dan Kulit Q : 7 adalah kulit
terjauh.
Atom tersusun atas partikel-partikel penyusun atom atau
partikel subatom yaitu neutron (n), proton (p), dan elektron (e). Neutron dan
proton membentuk inti atom. Elektron menempati kulit-kulit atom yang ada di
sekitar inti. Elektron-elektron tersebut mengelilingi inti dengan kecepatan
tinggi membentuk awan elektron. Elektron dan proton merupakan partikel subatom
yang mempunyai muatan berlawanan, sedangkan neutron tidak bermuatan. Elektron
memiliki muatan negatif sedangkan proton memiliki muatan positif.
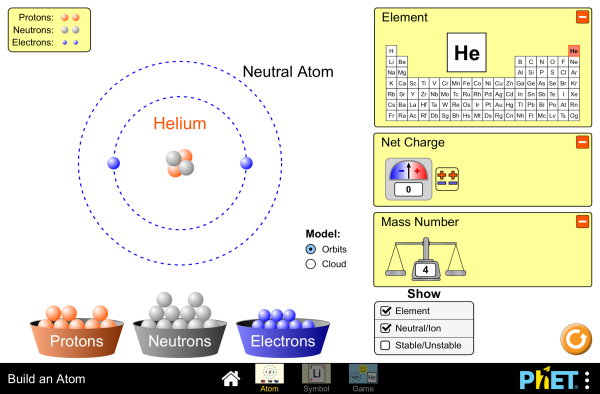
|
Model Sederhana
Atom Helium (He)
Sumber: Dokumen
Kemdikbud dari web
https://drive.google.com/file/d/0B0z0-7vc3HmeTXFMUVpXU3VhNk0/view
|
Pada atom netral, jumlah proton dan jumlah elektron sama
banyaknya. Masing-masing partikel penyusun subatom tersebut mempunyai massa.
Elektron mempunyai massa sangat kecil dibandingkan dengan massa proton dan
neutron. Oleh sebab itu massa atom akan terpusat pada inti atom saja.
Para ilmuwan telah mempelajari atom sejak ratusan tahun
lalu. Para ilmuwan tersebut mengemukakan teori-teori tentang atom. Teori yang
satu akan runtuh atau ditolak ketika ada data atau fakta baru yang ditemukan
tentang atom sehingga melahirkan teori atom yang baru. Berikut ini
merupakan perkembangan teori atom.
Tabel
Perkembangan Teori Atom
Penemu/Teori
Atom
|
Model
|
Penjelasan
|
John Dalton
|
Atom sebagai bola
pejal dan
merupakan bagian
terkecil yang
tidak dapat dibagi
lagi. Setiap
unsur terdiri atas atom-atom yang
identik satu sama lain. Atom-atom dari unsur berbeda mempunyai atom berbeda.
Atom-atom dapat bergabung dengan perbandingan tertentu membentuk senyawa.
|
|
Joseph John Thomson
|
Atom merupakan bola
bermuatan
positif dan di
tempat-tempat
tertentu terdapat elektron-elektron
yang bermuatan negatif seperti kismis dalam roti.
|
|
Ernest Rutherford
|
Atom sebagai bola yang di
tengahtengahnya terdapat inti atom yang merupakan pusat muatan positif dan
pusat massa. Sedangkan elektron-elektron berputar mengelilingi inti.
|
|
Niels Bohr
|
Atom terdiri
terdiri atas inti yang menjadi pusat massa atom dan pusat muatan positif.
Sedangkan elektron bergerak disekeliling inti pada lintasan tertentu (orbit)
yang
disebut kulit-kulit atom. Selama
elektron mengelilingi inti, elektron tidak memancarkan energi.
|
|
Modern
(Mekanika
Gelombang)
|
Atom tersusun atas
partikel sub
atom yaitu neutron
(n), proton
(p), dan elektron (e). Neutron dan
proton menjadi satu membentuk inti yang padat disebut nukleus atau inti atom.
Elektron bergerak disekeliling inti hampir dalam kecepatan cahaya membentuk
awan elektron.
|
Sumber
: (Mentri Pendidikan dan Kebudayaan, 2015: 177)
Teori atom yang paling kini adalah teori atom mekanika
gelombang. Menurut Bohr, atom mempunyai kulit-kulit atom tempat elektron
mengelilingi inti atom. Kulit atom yang paling dekat dengan inti atom mempunyai
energi paling rendah. Kulit atom yang lebih di luar mempunyai energi lebih
tinggi. Elektron yang berada pada kulit atom paling dalam dapat berpindah ke
kulit atom yang lebih luar bila menyerap energi dari luar atom. Energi itu
dapat berasal dari panas pembakaran atau dari energi listrik yang melewati
atom-atom itu. Elektron yang terletak pada kulit atom paling luar akan
mendapatkan gaya tarik yang lemah dari inti atom. Oleh karena itu elektron pada
kulit atom paling luar mudah lepas dari kulit itu, sehingga atom dapat
kehilangan elektron. Bila jumlah elektron dan jumlah proton dalam suatu atom
tidak sama maka atom tersebut akan bermuatan atau menjadi ion. Proses
pembentukan ion disebut ionisasi.
2. Nomor Atom dan Nomor Massa
Unsur merupakan zat tunggal (murni) yang tidak dapat diubah
lagi menjadi bahan lain dengan reaksi kimiawi, seperti emas, besi, perak,
oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang
ditemukan di alam. Masing-masing unsur tersebut memiliki karakteristik yang
berbeda-beda. Atom-atom dari unsur yang berbeda memiliki jumlah partikel
subatom yang berbeda. Semua atom dalam suatu unsur tertentu memiliki jumlah
proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur.
Nomor massa suatu atom ditentukan oleh jumlah dari neutron, proton, dan
elektron. Namun, karena massa elektron sangat kecil, maka dapat diabaikkan.
Atom yang satu berbeda dengan atom yang lain karena mempunyai elektron, proton,
dan neutron yang berbeda jumlahnya. Jika massa atomnya berbeda maka jari-jari
bola atom itu akan berbeda pula.
Hubungan nomor atom, nomor massa, dan jumlah neutron dalam
suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan
berikut.
Nomor atom = Jumlah
proton (p) dalam suatu atom = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Pada penulisan lambang unsur, nomor atom ditulis subscrip
(turun) di kiri lambang unsur, sedangkan nomor massa ditulis superscrip (naik)
di kiri atas lambang unsur, sebagaimana berikut.
Atom dan Partikel Penyusunnya
Sumber
: (Mentri Pendidikan dan Kebudayaan, 2015: 183)
Keterangan:
e = elektron; p = proton; n = neutron; Z = nomor atom A = nomor massa
e = elektron; p = proton; n = neutron; Z = nomor atom A = nomor massa
Click to Run
|
Kementrian Pendidikan dan Kebudayaan.
2015. Ilmu Pengetahuan Alam. Jakarta: Mentri Pendidikan dan Kebudayaan.
Campbell. 2008. Biologi Edisi Kedelapan
Jilid 1. Jakarta: Erlangga.
http://phet.colorado.edu/en/simulation/build-an-atom
http://phet.colorado.edu/en/simulation/build-an-atom
https://drive.google.com/file/d/0B0z0-7vc3HmeTXFMUVpXU3VhNk0/view
















0 comments: